中国博后一作Cell论文:发现常见痴呆症的关键大脑修复机制,并通过“老药新用”恢复大脑功能
来源:生物世界 2025-07-03 09:35
这些结果揭示了血管性痴呆(VaD)中的细胞间信号转导通路,并为开发治疗血管性痴呆的创新疗法奠定了基础。
血管性痴呆(VaD)约占所有痴呆病例的 25%,是仅次于阿尔茨海默病(AD)的第二常见痴呆类型。值得注意的是,血管性痴呆(VaD)常与阿尔茨海默病(AD)共存,84% 的老年人同时表现出血管性痴呆的形态特征和阿尔茨海默病的病理变化,表明这两种疾病可能存在累加或协同作用。
尽管血管性痴呆(VaD)的发病率很高,且对全球健康有着深远影响,但其潜在发病机制仍知之甚少。目前,尚无针对血管性痴呆(VaD)的直接治疗方法,现有的对症疗法(例如胆碱酯酶抑制剂和美金刚)疗效有限,且未能针对潜在的血管病变。这些知识空白凸显了开展全面研究的紧迫性,以确定治疗靶点,并在能准确模拟人类血管性痴呆(VaD)多样病因的动物模型中验证其可转化性。
2025 年 6 月 30 日,加州大学洛杉矶分校 S. Thomas Carmichael 团队(博士后田敏为第一作者)在国际顶尖学术期刊 Cell 上发表了题为:Deconstructing the intercellular interactome in vascular dementia with focal ischemia for therapeutic applications 的研究论文。
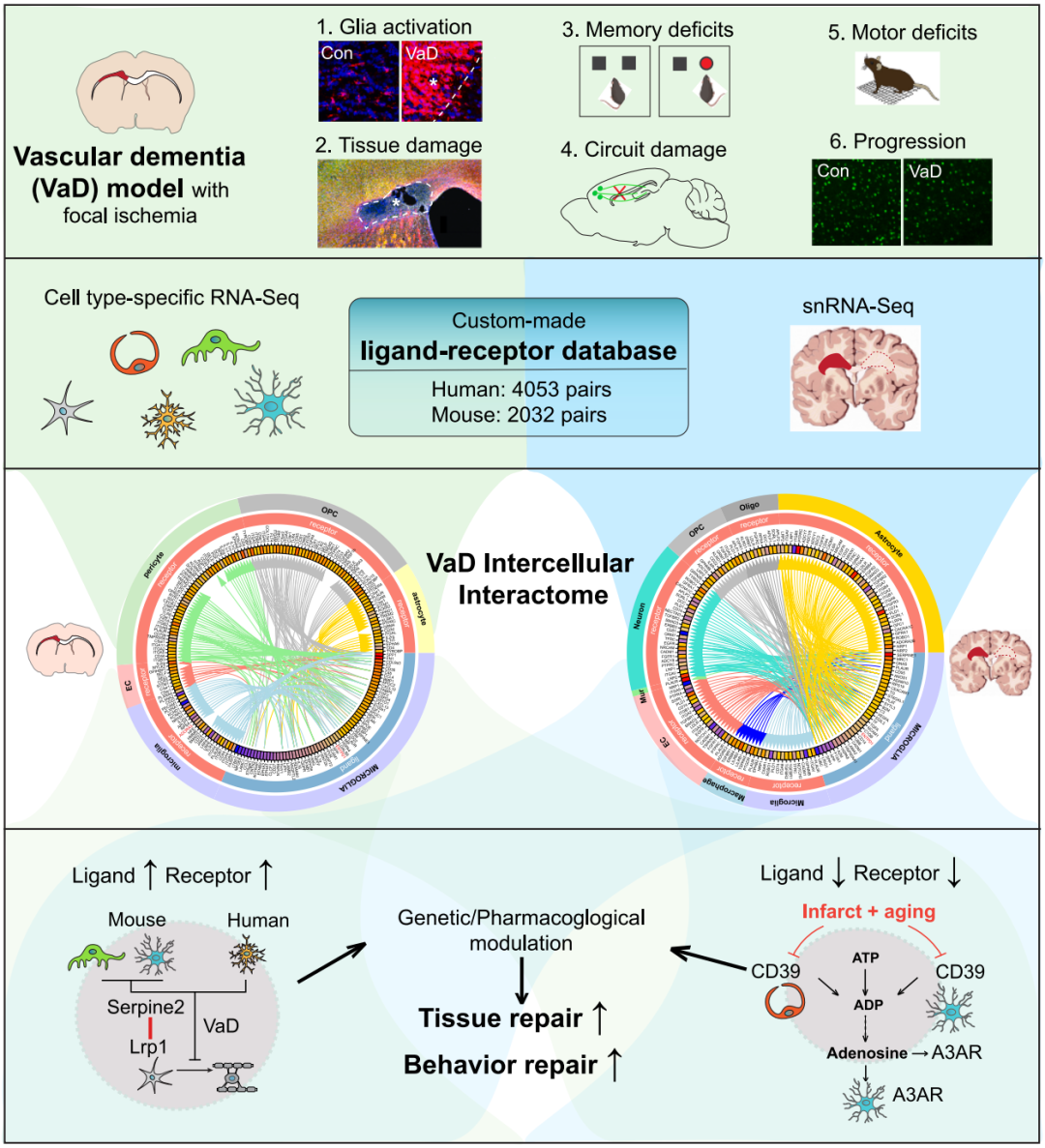
血管性痴呆(VaD)是仅次于阿尔茨海默病(AD)的痴呆症第二大病因,主要是一种白质缺血性疾病,目前尚无直接疗法,病变部位内的细胞间相互作用决定着疾病的进展或修复。该研究结合小鼠模型和人类数据,确定了血管性痴呆的大脑修复的关键信号通路——CD39-A3AR,并证明了一种处于 3 期临床试验阶段的治疗银屑病的 A3AR 特异性激动剂——Piclidenoson,能够促进大脑组织的修复,并恢复记忆和步态功能。有望为血管性痴呆这种研究不足的主要痴呆类型带来首个有效治疗方法。


作为血管性认知障碍和痴呆(VCID)中最严重的一种,血管性痴呆(VaD)在疾病建模和疗法开发方面带来了独特的挑战。VCID 是一个更精确、更现代且被广泛接受的术语,用于描述因脑部血液供应受损而导致认知能力下降的一系列综合征;VaD 则是由脑血管疾病导致的脑血流受损引起的,包括缺血性中风、微梗死或慢性小血管病。
临床上,血管性痴呆(VaD)通过磁共振成像(MRI)高信号来诊断,这些高信号是皮质下和脑室周围白质(WM)中小血管疾病的替代标志。尽管啮齿类动物模型在血管性痴呆(VaD)研究中发挥了重要作用,但它们往往无法完全再现人类疾病。因此,迫切需要能够重现人类血管性痴呆(VaD)特定神经病理特征的动物模型,包括更集中于白质的神经胶质细胞激活和磁共振成像(MRI)高信号、脑回路中断、进行性组织损伤以及记忆和运动功能障碍。
血管性痴呆(VaD)研究进展的一大障碍在于对神经血管单元(NVU)内细胞类型特异性反应的不完全理解——这是多种细胞类型之间动态相互作用的结果。这种神经血管单元维持细胞内环境稳定,并通过复杂的细胞间相互作用协调对损伤的反应,这种相互作用由配体-受体(L-R)信号转导所介导。
在血管性痴呆(VaD)中,缺血性损伤始于内皮细胞,并通过神经血管微环境传播,破坏细胞间通讯,导致组织损伤和认知能力下降。对单个细胞群进行转录组分析对于揭示血管损伤如何引发病理级联反应至关重要。细胞类型特异性 RNA 测序(RNA-seq)和 配体-受体(L-R)对数据库的最新进展,使得对包括阿尔茨海默病在内的神经疾病中细胞间通讯的系统性探索成为可能。然而,血管性痴呆(VaD)相关的细胞间网络或“相互作用组”在很大程度上仍未被探索。
总的来说,推进血管性痴呆(VaD)研究需要双管齐下:一是对神经血管单元(NVU)细胞进行高分辨率转录组学剖析,以揭示疾病机制;二是开发下一代动物模型,弥合啮齿类动物病理生理学与人类临床异质性之间的差距。
为应对上述挑战,研究团队开发了一种能够模拟人类血管性痴呆(VaD)的具有局灶性缺血的血管性痴呆小鼠模型,该小鼠模型重现了人类血管性痴呆中最常见部位的局灶性白质缺血性病变。与现有模型不同,这种方法使用野生型 C57BL/6J 小鼠,导致进行性神经元损伤以及长期运动和认知功能障碍。
通过整合细胞类型特异性小鼠血管性痴呆(VaD)转录组和人类 VaD 单细胞核 RNA 测序(snRNA-seq)数据,再加上一个定制的配体-受体数据库(4053 个人类和 2032 个小鼠配体-受体对),研究团队构建了一个全面的 VaD 相互作用网络,确定了在人类和小鼠中均发生改变的保守信号通路。
从这一 VaD 相互作用网络中,研究团队证明,其中两种细胞间信号转导系统——Serpine2-Lrp1 和 CD39-A3AR 在血管性痴呆(VaD)中受到破坏。前者负责调控少突胶质细胞分化和髓鞘形成;后者负责调控小胶质细胞活化和组织修复。
为了验证 CD39-A3AR 是否可作为治疗血管性痴呆(VaD)的潜在药物靶点,研究团队团队使用了正在进行 3 期临床试验中用于治疗银屑病的 A3AR 特异性激动剂——Piclidenoson,结果显示,当给血管性痴呆小鼠模型使用这种药物后,能够促进大脑组织的修复,并恢复了记忆和步态功能。
该研究的核心发现:
一种小鼠模型重现了伴有局灶性缺血的人类血管性痴呆(VaD)的病理特征和病程发展;
通过定制的配体-受体数据库鉴定出血管性痴呆的保守的细胞间相互作用组;
在血管性痴呆中,Serpine2-Lrp1 信号转导的减弱对少突胶质前体细胞的分化发挥着一定作用;
增强 CD39-A3AR 信号转导可能有助于血管性痴呆患者组织和行为的恢复。
论文第一作者、加州大学洛杉矶分校博士后田敏博士表示,这项研究中最令人兴奋的发现是,即使治疗干预延迟了,仍然有效。这一点至关重要,因为血管性痴呆通常诊断较晚。通过靶向血管与大脑细胞之间的相互作用,我们是在解决损伤的根本原因,而不仅仅是掩盖症状。
总的来说,这些结果揭示了血管性痴呆(VaD)中的细胞间信号转导通路,并为开发治疗血管性痴呆的创新疗法奠定了基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


